Угольная кислота и её соли - получение и применение
Угольная кислота появляется в результате разложения углекислого газа в водной среде. Этим веществом искусственно насыщают минеральные воды. Формула угольной кислоты Н2СО3. Поэтому при открытии бутылки с газированной водой, можно увидеть активные пузырьки. Основное получение угольной кислоты происходит в воде.
Уравнение
СО2 (г) + Н2О СО2 • Н2О (раствор) Н2СО3 Н+ + HCO3- 2H+ + CO32-.
Сама по себе угольная кислота представляет слабое непрочное соединение, которое невозможно выделить в свободном состоянии из воды.
Структурная формула
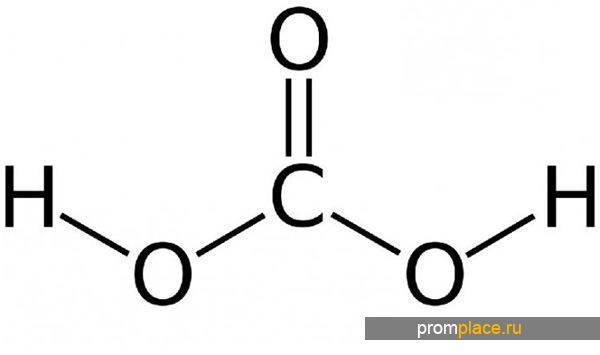
Но стоит отметить тот факт, что во время разложения гидрокарбоната аммония, формируются устойчивые соединения угольной кислоты. Такие крепкие химические связи образуются только в период, когда гидрокарбонат аммония вступает в газовую фазу реакции.
Вещество является интересным объектом для изучения. Его изучают австралийские ученые уже более 6 лет. В безводном состоянии эта кислота напоминает прозрачные кристаллы, которые имеют высокую стойкость к низким температурам, но при нагревании кристаллы угольной кислоты начинают разлагаться.

Данное вещество считается слабым по своей структуре, но в тоже время, угольная кислота является сильнее борной. Весь секрет заключается в количестве атомов водорода. В составе угольной кислоты имеется два атома водорода, поэтому она считается двухосновной, а борная кислота - одноосновная.
Особенности солей угольной кислоты
Эта кислота считается двухосновной, поэтому может создавать соли двух видов:
- • карбонаты угольной кислоты – средние соли,
- • гидрокарбонаты – кислые соли.
Карбонатами угольной кислоты могут выступать в соединения: Na2СO3,(NH4)2CO3. Они не способны растворятся в водной среде. Кислые соли этого вещества включают в себя: бикарбонаты NaHCO3 , Ca(HCO3)2. Для получения гидрокарбонатов производят реакцию, в которой основными веществами являются: угольная кислота и натрий.

Соли угольной кислоты помогли человечеству в строительстве, медицине и даже кулинарии. Потому что они встречаются в составе:
- • мела,
- • пищевой, кальцинированной и кристаллической соды,
- • известняковой породы,
- • мраморного камня,
- • поташа.
Гидрокарбонаты и карбонаты кислоты могут вступать в реакции с кислотами, во время этих реакции возможно выделение углекислого газа. Также эти вещества могут быть взаимозаменяемыми, они способны разлагаться под воздействием температуры.
Реакции угольной кислоты:
2NaHCO3 → Na2CO3 +H2O +CO2
Na2CO3 + H2O + CO2 →2NaHCO3
Химические свойства
Данная кислота по своей структуре способна входить в реакции со многими веществами.
Свойства угольной кислоты раскрываются в реакциях:
- • диссоциации,
- • с металлами,
- • с основаниями,
- • с основными оксидами.
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
Угольная кислота представляет собой слабый электролит, так как слабая летучая кислота не может выступать в роли мощного электролита в отличие от, например, соляной кислоты. Этот факт можно увидеть в результате добавление лакмуса в раствор угольной кислоты. Изменение цвета будет незначительным. Поэтому можно утверждать, что угольная кислота может поддерживать 1 уровень диссоциации.
Применение
Данное вещество можно увидеть в составе газированных вод. Но соли угольной кислоты широко применяют:

- • для строительной сферы,
- • в процессе производства стекла,
- • в процессе производства моющих и чистящих средств,
- • производства бумаги,
- • для некоторых подкормок и удобрений для растений,
- • в медицине.
Отечественный и мировой рынок предлагает в продаже различные препараты и химические вещества, в состав которых входит угольная кислота:
- • мочевина или карбамид,
- • литиевая соль угольной кислоты,
- • углекислый кальций (мел),
- • кальцинированная сода (натрий углекислый) и т.д.
Карбамид используют в качестве удобрения для плодовых и декоративных растений. Его средняя цена составляет 30-40 рублей за 1 кг. Фасуют готовую продукцию в полиэтиленовые пакеты и мешки, весом 1, 5,25,50 кг.
Литиевую соль угольной кислоты используют в составе керамических изделий, ситаллов. Этот материал используется для производства камер сгорания для реактивных двигателей, его добавляют в глазури, эмали, грунтовки для различных металлов. Литиевую соль добавляют в грунтовки для обработки алюминия, чугуна и стали.
Это химическое вещество добавляют в процессе стекловарения. Стекла, в состав которых была добавлена литиевая соль, имеют повышенную проницаемость светлового потока. Иногда литиевую соль угольной кислоты используют в процессе производства пиротехники.
Производители
Средняя цена 1 кг такого вещества в России составляет 3900-4000 рублей. Главным заводом-изготовителем этого вещества считается московский завод ООО Компонент-Реактив. Также литиевую соль угольной кислоты производят в компаниях: ООО КурскХимПром, ООО ВитаХим, ООО Русхим, ЗАО Химпэк.
Мел производится для технических и кормовых целей. Средняя цена кормового мела составляет 1800 рублей за 1 тонну. Фасуется в основном по 50 кг, 32 кг. Производители: ООО Меловик, ООО МТ Ресурс, ООО Зооветснаб, ООО Агрохиминвест.
Кальцинированная сода применяется для стирки, удаления пятен и отбеливания. Средняя цена на этот продукт на розничном рынке варьируется в пределах 16-30 рублей за 1 кг. Производители: ООО Новэра, ЗАО ХимРеактив, ООО ХимПлюс, ООО СпецБурТехнологии, ООО СпецКомплект и др.

|
Натриевая соль муравьиной кислоты обладает отличными пластифицирующими свойствами, а потому широко используется в строительной сфере в качестве добавки в бетонные и железобетонные конструкции......
|

|
Этот формальдегидный полимер пользуется спросом на рынке химической промышленности. Вещество активно применяется как высокоэффективное дезинфицирующее средство ......
|

|
На международном рынкенатриевая соль лаурилсерной кислоты представлена под названием sodium laureth sulfate. Вещество активно используется в производстве косметики, машинных масел ......
|

|
Впервые дихлорметан был получен путем выдержки смеси из хлора и метила. Современные компании используют иной способ получения вещества - путем хлорирования метана ......
|

